发布时间:2023-02-16 浏览次数:1229
近日,国家药监局重磅发布《中药注册管理专门规定》(以下简称“专门规定:)。
介乎于《药品注册管理办法》和系列药品研制技术指导原则之间的规范性文件,走向了注册审评体系的聚光灯下,将于今年7月1日正式施行。
面对重磅落地的《专门规定》,中药企业可谓几家欢喜几家愁。
大批中药企业将停产?新一轮行业洗牌开始!
五大核心要点
《专门规定》共11章82条,与新修订《药品管理法》、《药品注册管理办法》有机衔接,结合了中医药的理论基础,充分吸纳了药品审评审批制度改革的成熟经验,有以下五大核心要点:
1、审批体系“中国化”:要求推进中医药理论、人用经验和临床试验“三结合”,建立具有中药特点的审评审批体系;
2、评价体系“中药化”:中药的疗效评价应当结合中医药临床治疗特点,鼓励运用传统中药研究方法和现代科学技术研究开发中药,形成结合中医药临床治疗特点的中药疗效评价指标;同时,鼓励将真实世界研究、新型生物标志物、替代终点决策、以患者为中心的药物研发、适应性设计、富集设计等用于中药疗效评价。
3、开发路径“创新化”:明确中药注册分类、研发路径和模式,并对古代经典名方中药复方制剂的上市申请、临床定位清晰且具有明显临床价值的中药新药等注册申请提出简化审批、优先审批、附条件审批、特别审批的相应规定;
4、经典名方“现代化”:支持研制基于古代经典名方、名老中医经验方、医疗机构中药制剂等具有丰富中医临床实践经验的中药新药,鼓励应用新兴科学和技术研究阐释中药的作用机理;来源于临床实践的中药新药,人用经验能在临床定位、适用人群筛选、疗程探索、剂量探索等方面提供研究、支持证据的,可不开展ii期临床试验。
5、药品注册“规范化”:明确中药注册标准的研制目标,支持探索建立整体质量控制方法和持续完善中药质量标准体系,明确中药通用名称的命名要求,对已上市中药的说明书完善提出了要求。
大批中药企业将停产?
《专门规定》的审批体系“中国化”、评价体系“中药化”、开发路径“创新化”、经典名方“现代化”,对中药创新药是一个利好。
特别是要求推进中医药理论、人用经验和临床试验“三结合”的具有中药特点的审评审批体系,可谓是为中医药量身打造,过往中药新药综合评价中药的安全性、有效性和质量可控性的很多问题,迎刃而解。
在新的体系下,中药研发投入产出比有望迅速提升。
此外,《专门规定》对临床定位清晰且具有明显临床价值的5种情形中药新药等的注册申请实行优先审评审批,并依法简化古代经典名方中药复方制剂审批,中药的获批速度有望加快。
过去几年,中药创新药获批速度逐步迎来复苏,《专门规定》的出台,有望进一步引导中药创新药步入“快车道”。
中药创新药步入“对数增长期”,相关企业也有望从“估值修复”走向“拔估值”。
对中药创新药的“友好”,也引来了资本市场的欢愉。
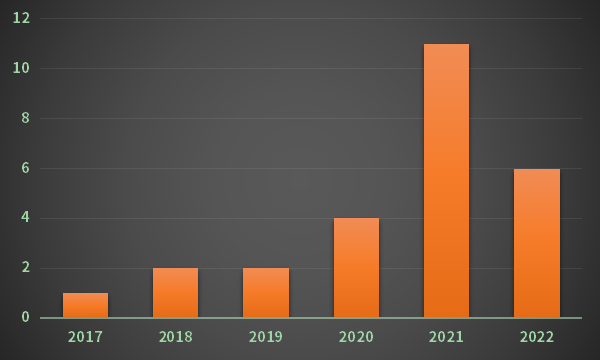
图1 2017-2022年中药创新药获批上市数量
数据来源:药智数据
但是,就像硬币有两面,鼓励良币,则必驱逐劣币。
《专门规定》还专门留了一个章节,专门阐述“药品名称和说明书”要求,特别提到:中药说明书【禁忌】、【不良反应】、【注意事项】中任何一项在申请药品再注册时仍为“尚不明确”的,不予再注册。
也就意味着,未来中药将不再享有说明书方面的“特权”。
说明书再不修订,就踢出市场。
由于历史原因,我国约有七成以上中药说明书中,【禁忌】、【不良反应】、【注意事项】至少一栏为尚不明确。
根据药智数据,我国中药的批文总数为57526个,即至少涉及4万个中药批文需要考虑再注册的问题。
对中药企业而言,中药不良反应“尚不明确”的药品之后无法生存,那企业就需要做一系列的循证研究,把中药说明书具体化。
循证研究涉及到安全性、有效性、经济性、创新性、适宜性、可及性等多个维度,这些科学规范的药品临床综合评价是一笔不菲的开销。
如果是年销售过亿元的产品,花几百万补充研究,既是一个学术推广的过程,也是一种延长产品生命周期的方式,企业会乐于去做。
如果是年销售几十万,或是刚过百万级别,那么花几百万的代价做补充研究,企业就陷入两难的境地。
虽然中成药没有一致性评价的洗牌,但这一次《专门规定》的出台,预计未来几年,市场上大量说明书或者注册信息不清晰的中药批文可能被清退,变相来了一个洗牌。
公开资料显示,近几年来,国家药监局发布了100多种中药说明书修订的公告,其中“禁忌”项和“不良反应”项等安全信息项内容为修订的重点。
信息不完整、不规范等问题一直是中成药说明书需要面对的问题。
更深层次,中药说明书的修订将直接影响到再注册、基药、医保准入以及中药品种保护等多个方面。
中药说明书修改已迫在眉睫,对于具体的中药企业而言:
基于前期研发底蕴下中药创新领军企业已完善主要品种的说明书安全性信息,有望借助政策红利占据更多市场份额;
部分企业已前瞻性开展主要非独家大品种的循证医学研究,可借助资金优势开展循证医学临床或真实世界研究完善说明书,非独家品种市场份额将向龙头企业集中,有望发挥科学的力量;
中药企业在未来3年将持续开展循证医学研究,有望带动中药cro行业的发展,特别是中药临床cro相关的。
如何应对
新一轮行业洗牌?
全方位、系统的中药注册管理体系对中医药行业持续规范升级将产生积极推动作用,有望促进行业长期高质量发展。
《专门规定》其实变相是倒逼企业向创新转型,中药企业对于管线的布局、发展方向也更加明确。
面对《专门规定》,中药企业可以有以下的应对措施:
1、将药品的基本要求与中药特殊性有机结合,开发过程中综合考虑药品安全性、有效性、质量可控性;
2、辩证处理好中药传承与创新的关系,注重体现中医药原创思维及整体观,又要适当结合现代科学技术;
3、可以重点挖掘“人用经验”:中药研制一般具有“源于临床,用于临床”的特点,这次文件设立专章,对中药人用经验的具体内涵,作为支持中药安全性、有效性证据的合规性、药学研究要求。同时还明确研制时可根据中药人用经验选择不同的临床研究路径,人用经验方有望是一个价值放大器;
4、合理利用中药疗效评价指标的多元性,《专门规定》列举了可作为中药疗效评价的8种情形,可以充分运用。
5、合理利用新兴科学和技术研究阐释中药的作用机理,比如ai技术。药智npaiengine天然产物ai研发平台正致力于解决这一大行业难题。(详情请点击:重磅!《中药注册管理专门规定》发布,涉及2w+中成药)
结语
中医药的春风来了,是春暖花开,还是“倒春寒”?考验着中药企业的魄力与选择。